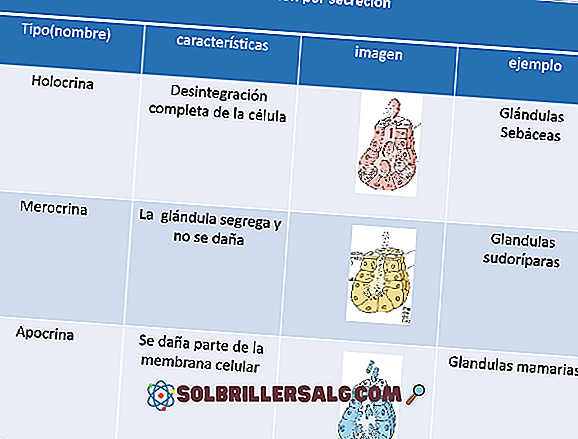
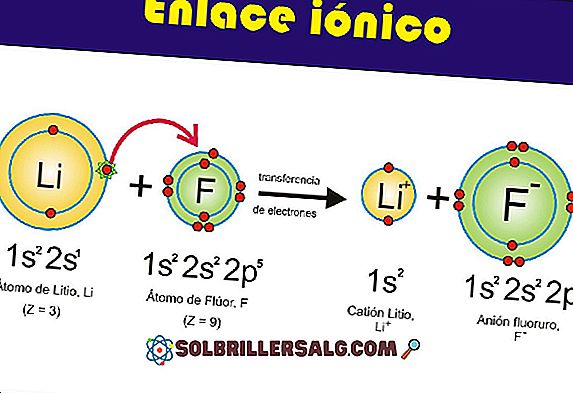
Hydroxydes: propriétés, nomenclature et exemples
Les hydroxydes sont des composés inorganiques et ternaires qui consistent en une interaction entre un cation métallique et le groupe fonctionnel OH (hydroxyde anion, OH-). La plupart d'entre eux sont de nature ionique, bien qu'ils puissent également avoir des liaisons covalentes.
Par exemple, un hydroxyde peut être représenté par l'interaction électrostatique entre le cation M + et l'anion OH-, ou par la liaison covalente via la liaison M-OH (image inférieure). Dans le premier cas, la liaison ionique est donnée, tandis que dans le second, la liaison covalente. Ce fait dépend essentiellement du cation métal ou M +, ainsi que de sa charge et de son rayon ionique.

Parce que la plupart d'entre eux proviennent de métaux, cela revient à les mentionner en tant qu'hydroxydes de métaux.
Comment sont-ils formés?
Il existe deux voies de synthèse principales: en faisant réagir l'oxyde correspondant avec de l'eau ou avec une base forte en milieu acide:
MO + H 2 O => M (OH) 2
MO + H + + OH- => M (OH) 2
Seuls les oxydes métalliques solubles dans l’eau réagissent directement pour former l’hydroxyde (première équation chimique). D'autres sont insolubles et nécessitent des espèces acides qui libèrent du M +, qui interagit ensuite avec l'OH- des bases fortes (seconde équation chimique).
Toutefois, lesdites bases fortes sont les hydroxydes métalliques NaOH, KOH et d'autres du groupe des métaux alcalins (LiOH, RbOH, CsOH). Ce sont des composés ioniques hautement solubles dans l’eau, donc leur OH- est libre de participer aux réactions chimiques.
Par contre, il existe des hydroxydes métalliques insolubles et par conséquent des bases très faibles. Même certains d'entre eux sont acides, comme c'est le cas avec l'acide tellurique Te (OH) 6 .
L'hydroxyde établit un équilibre de solubilité avec le solvant qui l'entoure. S'il s'agit d'eau, par exemple, le solde est exprimé comme suit:
M (OH) 2 M2 + (ac) + OH- (ac)
Où (ac) indique que le milieu est aqueux. Lorsque le solide est insoluble, la concentration en OH dissous est faible ou négligeable. Pour cette raison, les hydroxydes de métaux insolubles ne peuvent pas générer de solutions aussi basiques que celles de NaOH.
De ce qui précède, on peut déduire que les hydroxydes présentent des propriétés très différentes, liées à la structure chimique et aux interactions entre le métal et l’OH. Ainsi, bien que beaucoup soient ioniques, avec des structures cristallines variées, d’autres, au contraire, ont des structures polymères complexes et désordonnées.
Propriétés des hydroxydes
Anion OH-
L'ion hydroxyle est un atome d'oxygène lié de manière covalente à un atome d'hydrogène. Ainsi, cela peut être facilement représenté par OH-. La charge négative est située sur l'oxygène, faisant de cet anion une espèce donneuse d'électrons: une base.
Si l'OH donne ses électrons à un hydrogène, il se forme une molécule d'H 2 O. Il peut également donner ses électrons à des espèces chargées positivement, comme les centres de métaux M +. Ainsi, un complexe de coordination est formé par la liaison dative M-OH (l’oxygène contribue au couple d’électrons).
Cependant, pour que cela se produise, l’oxygène doit pouvoir se coordonner efficacement avec le métal, sinon les interactions entre M et OH auront un caractère ionique marqué (M + OH-). Comme l'ion hydroxyle est le même dans tous les hydroxydes, la différence entre tous réside alors dans le cation qui l'accompagne.
De plus, comme ce cation peut provenir de n’importe quel métal du tableau périodique des groupes (groupes 1, 2, 13, 14, 15, 16 ou des métaux de transition), les propriétés de ces hydroxydes varient énormément, bien que tous envisagent de: certains aspects communs.
Caractère ionique et fondamental
Dans les hydroxydes, bien qu’ils aient des liaisons de coordination, ils ont un caractère ionique latent. Dans certains cas, comme NaOH, leurs ions font partie d’un réseau cristallin constitué de cations Na + et d’anions OH- dans des proportions de 1: 1; en d'autres termes, pour chaque ion Na +, il existe une contrepartie, l'ion OH-.
En fonction de la charge en métal, il y aura plus ou moins d'anions OH tout autour. Par exemple, pour un cation métallique M2 +, il y aura deux ions OH-interaction avec lui: M (OH) 2, qui est indiqué par HO-M2 + OH-. La même chose se produit avec les métaux M3 + et les autres avec des charges plus positives (bien que dépassant rarement 3+).
Ce caractère ionique est responsable de nombreuses propriétés physiques, telles que les points de fusion et d'ébullition. Celles-ci sont élevées, ce qui reflète les forces électrostatiques qui agissent dans le réseau cristallin. De même, lorsque les hydroxydes sont dissous ou fondus, ils peuvent conduire le courant électrique en raison de la mobilité de leurs ions.
Cependant, tous les hydroxydes n'ont pas les mêmes réseaux cristallins. Ceux avec les plus stables seront moins susceptibles de se dissoudre dans des solvants polaires tels que l'eau. En règle générale, plus les rayons ioniques de M + et OH- sont disparates, plus ils seront solubles.
Tendance périodique
Ce qui précède explique pourquoi la solubilité des hydroxydes des métaux alcalins augmente avec la descente du groupe. Ainsi, l'ordre croissant de solubilités dans l'eau pour ces substances est le suivant: LiOH L'OH- est un petit anion et, à mesure que le cation devient plus volumineux, le réseau cristallin s'affaiblit énergiquement. En revanche, les métaux alcalino-terreux forment des hydroxydes moins solubles en raison de leurs charges positives plus élevées. En effet, le M2 + attire le OH- avec une force supérieure à celle de M +. De même, ses cations sont plus petits et donc moins inégaux en taille par rapport à OH-. Le résultat de ceci est la preuve expérimentale que NaOH est beaucoup plus basique que Ca (OH) 2 . Le même raisonnement peut être appliqué pour d'autres hydroxydes, soit ceux des métaux de transition, soit ceux des métaux du bloc p (Al, Pb, Te, etc.). En outre, plus le rayon ionique et la charge positive de M + sont petits et grands, plus le caractère ionique de l'hydroxyde est faible, en d'autres termes, ceux avec des densités de charge très élevées. Un exemple de cela se produit avec l'hydroxyde de béryllium, Be (OH) 2 . Be2 + est un très petit cation et sa charge divalente le rend très dense électriquement. Les hydroxydes M (OH) 2 réagissent avec les acides pour former un aquocomplexe, c’est-à-dire que les extrémités M + sont entourées de molécules d’eau. Cependant, il existe un nombre limité d'hydroxydes pouvant également réagir avec les bases. Ce sont ce qu'on appelle les hydroxydes amphotères. Les hydroxydes amphotères réagissent avec les acides et les bases. La deuxième situation peut être représentée par l'équation chimique suivante: M (OH) 2 + OH- => M (OH) 3 - Mais comment déterminer si un hydroxyde est amphotère? Par une simple expérience de laboratoire. Du fait que de nombreux hydroxydes métalliques sont insolubles dans l'eau, en ajoutant une base forte à une solution contenant les ions M + dissous, par exemple Al3 +, l'hydroxyde correspondant précipitera: Al3 + (ac) + 3OH- (ac) => Al (OH) 3 (s) Mais ayant un excès de OH, l'hydroxyde continue à réagir: Al (OH) 3 (s) + OH- => Al (OH) 4 - (ac) En conséquence, le nouveau complexe chargé négativement est solvaté par les molécules d’eau environnantes, ce qui dissout le solide blanc d’hydroxyde d’aluminium. Les hydroxydes qui restent inchangés avec l'addition de base supplémentaire ne se comportent pas comme des acides et ne sont donc pas amphotères. Les hydroxydes peuvent avoir des structures cristallines similaires à celles de nombreux sels ou oxydes; certains sont simples et d’autres très complexes. De plus, ceux où le caractère ionique diminue, peuvent présenter des centres métalliques reliés par des ponts à l'oxygène (HOM-O-MOH). En solution, les structures sont différentes. Bien que pour les hydroxydes très solubles, il suffit de les considérer comme des ions dissous dans l'eau, pour d'autres, il est nécessaire de prendre en compte la chimie de coordination. Ainsi, chaque cation M + peut être coordonné à un nombre limité d'espèces. Plus elle est volumineuse, plus le nombre de molécules d’eau ou d’OH liées à celle-ci est important. D'où le fameux octaèdre de coordination de nombreux métaux dissous dans l'eau (ou dans tout autre solvant): M (OH 2 ) 6 + n, n étant égal à la charge positive du métal. Cr (OH) 3, par exemple, forme en réalité un octaèdre. Comment Considérant le composé comme [Cr (OH 2 ) 3 (OH) 3 ], dont trois des molécules d'eau sont remplacées par des anions OH-. Si toutes les molécules étaient remplacées par OH-, le complexe de charge négative et de structure octaédrique [Cr (OH) 6 ] 3- serait alors obtenu. La charge -3 est le résultat des six charges négatives de l’OH-. Les hydroxydes peuvent être considérés comme des "oxydes hydratés". Cependant, chez eux, "l'eau" est en contact direct avec M +; tandis que dans les oxydes hydratés MO · nH 2 O, les molécules d’eau font partie d’une sphère de coordination externe (elles ne sont pas proches du métal). Lesdites molécules d'eau peuvent être extraites par chauffage d'un échantillon d'hydroxyde: M (OH) 2 + Q (chaleur) => MO + H 2 O MO est l'oxyde métallique formé à la suite de la déshydratation de l'hydroxyde. Un exemple de cette réaction est celui observé lors de la déshydratation de l’hydroxyde de cuivre, Cu (OH) 2 : Cu (OH) 2 (bleu) + Q => CuO (noir) + H 2 O Quelle est la bonne façon de mentionner les hydroxydes? L'IUPAC a proposé trois nomenclatures à cette fin: traditionnelle, standard et systématique. Il est correct d'utiliser n'importe lequel des trois, cependant, pour certains hydroxydes, il peut être plus pratique de le mentionner d'une manière ou d'une autre. La nomenclature traditionnelle consiste simplement à ajouter le suffixe -ico à la plus haute valence que présente le métal; et le suffixe -oso au plus bas. Ainsi, par exemple, si le métal M a des valences de +3 et +1, l'hydroxyde M (OH) 3 sera appelé hydroxyde (nom du métal) ico, tandis que l'hydroxyde de MOH (nom du métal) sera actif . Pour déterminer la valence du métal dans l'hydroxyde, il suffit d'observer le nombre après le OH entre parenthèses. Ainsi, M (OH) 5 signifie que le métal a une charge ou une valence de +5. Le principal inconvénient de cette nomenclature, cependant, est qu’elle peut être compliquée pour les métaux ayant plus de deux états d’oxydation (comme pour le chrome et le manganèse). Dans ce cas, les préfixes hyper et hypo sont utilisés pour désigner les valences les plus hautes et les plus basses. Ainsi, si M au lieu de n'avoir que les valences +3 et +1, il a aussi +4 et +2, les noms de ses hydroxydes de valences supérieure et inférieure sont: hyper hydroxyde (nom du métal) ico et hydroxyde d'hydroxyde ( nom du métal) ours . De toutes les nomenclatures, c'est la plus simple. Ici, le nom de l'hydroxyde est suivi simplement par la valence du métal entre parenthèses et écrit en chiffres romains. Toujours pour M (OH) 5, par exemple, sa nomenclature de stock serait: hydroxyde (nom du métal) (V). (V) désigne alors (+5). Enfin, la nomenclature systématique se caractérise par le recours à des préfixes multiplicateurs (di, tri, tétra, penta, hexa-, etc.). Ces préfixes sont utilisés pour spécifier à la fois le nombre d'atomes de métal et d'ions OH-. De cette façon, M (OH) 5 est nommé comme: pentahydroxyde (nom du métal). Dans le cas de Hg 2 (OH) 2, par exemple, ce serait le dihydroxyde de dimercurium; un des hydroxydes dont la structure chimique est complexe à première vue. Quelques exemples d'hydroxydes et de leurs nomenclatures correspondantes sont ceux qui suivent: -NaOH (hydroxyde de sodium)Anfoterismo
Des structures
Réaction de déshydratation
Nomenclature
Traditionnel
Stock
Systématique
Exemples d'hydroxydes

-Ca (OH) 2 (hydroxyde de calcium)

-Fe (OH) 3. ( hydroxyde ferrique, hydroxyde de fer (III) ou trihydroxyde de fer)
-V (OH) 5 ( hydroxyde pervanoïque, hydroxyde de vanadium (V) ou pentahydroxyde de vanadium).
-Sn (OH) 4 ( hydroxyde statique, hydroxyde d'étain (IV) ou tétrahydroxyde d'étain).
-Ba (OH) 2 (hydroxyde de baryum ou dihydroxyde de baryum).
-Mn (OH) 6 ( hydroxyde de manganèse, hydroxyde de manganèse (VI) ou hexahydroxyde de manganèse).
-AgOH (hydroxyde d'argent, hydroxyde d'argent ou hydroxyde d'argent). Notez que pour ce composé, il n'y a pas de distinction entre nomenclatures stock et nomenclatures systématiques.
-Pb (OH) 4 ( hydroxyde de plomb, hydroxyde de plomb (IV) ou tétrahydroxyde de plomb).
-LiOP (hydroxyde de lithium).
-Cd (OH) 2 (hydroxyde de cadmium)
-Ba (OH) 2 ( hydroxyde de baryum)
Hydroxyde de chrome